Il processo Birkeland-Eyde è stato un processo industriale utilizzato all'inizio del XX secolo per produrre fertilizzanti azotati. Fu sviluppato nel 1903 da Kristian Birkeland, scienziato e industriale norvegese, assieme al suo socio Samuel Eyde, basandosi su un metodo descritto da Henry Cavendish nel 1784. Fu uno dei primi processi chimici per effettuare la fissazione dell'azoto; in particolare il processo Birkeland-Eyde utilizzava un arco elettrico per trasformare l'azoto atmosferico (N2) in acido nitrico (HNO3).
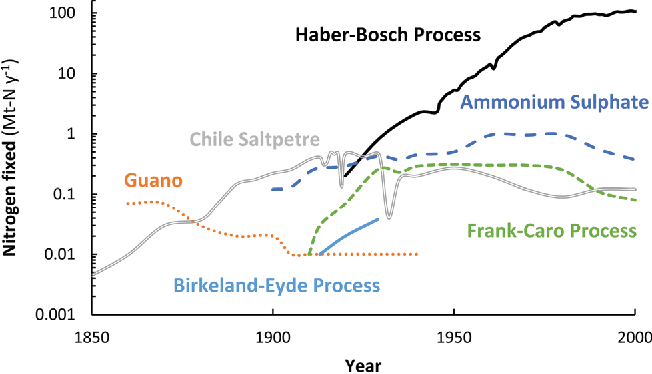
Il processo Birkeland-Eyde fu utilizzato in impianti costruiti a Rjukan e Notodden in Norvegia, sfruttando la vicinanza di un grande impianto idroelettrico. Il processo utilizzava un'enorme quantità di energia elettrica risultando quindi poco efficiente in termini di consumo elettrico. Di conseguenza, negli anni 1910-1920 fu gradualmente sostituito accoppiando il processo Haber-Bosch (fissazione dell'azoto tramite sintesi dell'ammoniaca) e il processo Ostwald (conversione dell'ammoniaca in acido nitrico).
Il processo
Tra due elettrodi coassiali veniva formato un arco elettrico, che era diffuso su un disco sottile tramite un forte campo magnetico. La temperatura del plasma sul disco superava i 3000 °C. Soffiando aria attraverso l'arco, una parte dell'azoto reagiva con l'ossigeno formando monossido di azoto (NO). Controllando con attenzione l'energia dell'arco e la velocità di flusso dell'aria si poteva ottenere una resa di NO fino al 4%. Il processo utilizzava un'enorme quantità di energia, che veniva prelevata dalla vicina centrale idroelettrica. Erano necessari circa 15 MWh per ogni tonnellata di acido nitrico. In natura i fulmini provocano la stessa reazione a partire da ossigeno e azoto presenti nell'atmosfera, dando luogo alla formazione di nitrati solubili.
- N2 O2 → 2NO
Il monossido di azoto surriscaldato veniva raffreddato e combinato con ossigeno atmosferico per formare diossido di azoto:
- 2NO O2 → 2NO2
Il diossido di azoto era quindi disciolto in acqua per formare acido nitrico, che veniva purificato per distillazione frazionata:
- 3NO2 H2O → 2HNO3 NO
Note
Bibliografia
- (EN) D. Erwin, Industrial Chemical Process Design, McGraw-Hill, 2002, ISBN 0-07-137621-6.
- (EN) K. Fisher e W. E. Newton, Nitrogen fixation at the millennium, a cura di G. J. Leigh, Elsevier, 2002, ISBN 0-444-50965-8.
- (EN) A. J. Ihde, The Development of Modern Chemistry, Dover, 1984, ISBN 978-0-486-64235-2.
- (EN) G. J. Leigh, The world's greatest fix: a history of nitrogen and agriculture, Oxford University Press, 2004, ISBN 0-19-516582-9.
- (EN) T. I. Williams, A Short History of Twentieth-Century Technology, c. 1900 - c. 1950, Oxford University Press, 1982, ISBN 0-19-858159-9.
Altri progetti
- Wikimedia Commons contiene immagini o altri file su Processo Birkeland-Eyde